Kreatyna oraz jej pochodna fosfokreatyna należy obecnie do najczęściej stosowanych suplementów w sporcie, a w szczególności w dyscyplinach, w których na wynik istotnie wpływa potencjał siłowy. Wiąże się to z faktem, dodatniego wpływu kreatyny na moc maksymalną zależną od potencjału siłowego, rozwijaną poprzez trening oporowy [Rowson i Persky 2007]. Ponadto liczne prace naukowe potwierdzające jej wpływ na rozwój beztłuszczowej masy mięśniowej oraz takie funkcje jak zmniejszenie zakwaszenia, czy usprawnianie metabolizmu tlenowego poprzez zwiększenie aktywności syntazy cytrynianowej, doprowadziły do silnej popularyzacji suplementacji kreatyną praktycznie w każdym rodzaju treningu oporowego, szybkościowego i niektórych formach treningu wydolnościowego oraz na każdym poziomie zaawansowania. [Kreider 2003, Kreider 2003, Rawson i Volek 2003, Volek i Rawson 2004, Vandebuerie i wsp. 1998, Tesch i wsp. 1989, Burke i wsp. 2003, Lukaszuk i wsp. 2002, Casey i wsp. 1996, Greenhaff i wsp. 1994, Hultmanni wsp. 1996, Preen i wsp. 2001, Stanton i Abt 2000, Zając 2003]. Z tego względu suplementacja kreatyną stała się podstawowym mechanizmem wspomagania treningu oporowego i zarazem praktycznie najbardziej znanym i rozpoznawanym suplementem wśród zawodników.
Metabolizm
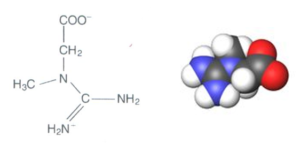
Kreatyna, czyli kwas α-metyloguanidynooctowy, (C4H9N3O2) jest związkiem o ładunku obojętnym i masie cząsteczkowej 131Da. W endogennej syntezie kreatyny uczestniczą trzy aminokwasy: glicyna, arginina i metionina [Bloch, 1941] (ryc.1, 2).
Ryc. 1. Wzór strukturalny i przestrzenny (3D) cząsteczki kreatyny
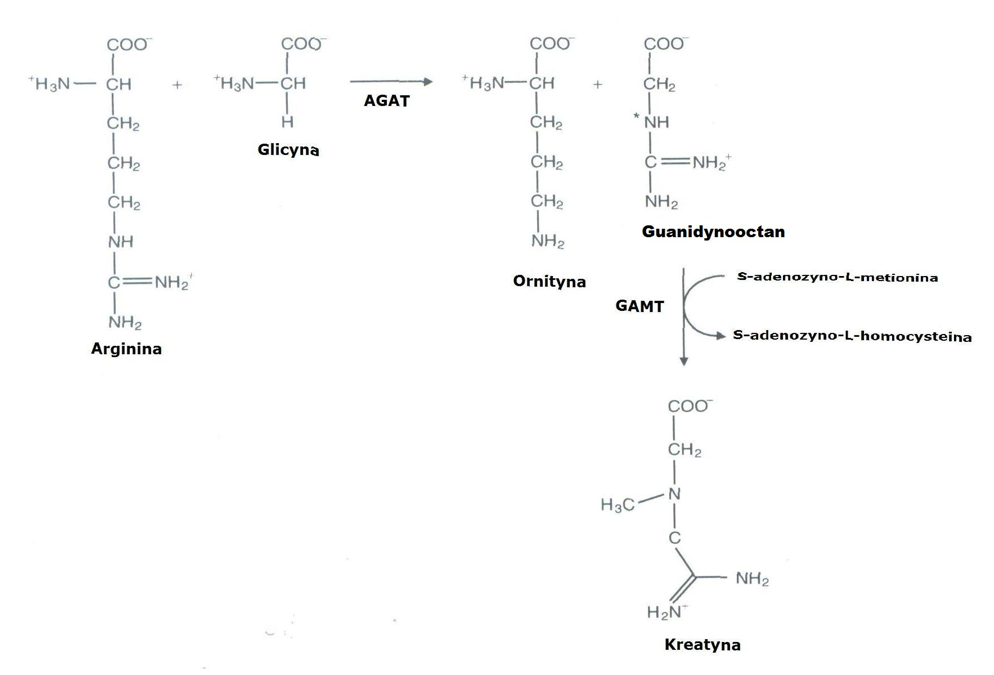
Synteza ta zaczyna się od transferu grupy amidynowej z argininy do glicyny, co prowadzi do powstania L-ornityny i kwasu guanidynooctowego. Reakcja ta jest katalizowana przez amidynotransferazę arginino glicynową (AGAT). Obecnie uważa się, że guanidynooctan jest tworzony w nerkach i przenoszony przez krew do wątroby [Wyss, 2000]. W komórkach wątroby (hepatocytach) guanidynooctan ulega procesowi metylacji (dołączenia grupy metylowej) grupy amidynowej w obecności koenzymu S-adenozylo-L-metioniny (SAM) i enzymu metylotransferazy N-guanidynooctowej (GAMT). W następstwie tej reakcji powstaje kreatyna i S-adenozyno-L-homocysteina. Tempo tej reakcji jest ograniczone formowaniem się guanidynooctanu w obecności amidynotransferazy (AGAT). Natomiast powstała w tej reakcji kreatyna może wywołać sprzężenie zwrotne hamujące amidynotransferazę (AGAT) przez wpływ na proces transkrypcji AGAT z mRNA. Endogenna synteza kreatyny dostarcza średnio 1-2g/d i zachodzi głównie w wątrobie [Sandberg, 1953], a także w mniejszym stopniu w trzustce i nerkach oraz innych narządach i tkankach [Walker, 1979].
Dodatkowo 1-2g/d kreatyny organizm uzyskuje z diety zawierającej głównie ryby i mięso (4,5-5,0 g kreatyny/ kg łososia lub wołowiny) [Balsom, 1994]. Zatem w ciągu dnia łącznie dostarczane jest do krwiobiegu 2g kreatyny. Ilość pobieranej kreatyny z pokarmu jest cechą wysoce indywidualną. Zwiększone spożycie kreatyny w diecie (dieta zawierająca duże ilości ryb i mięs) automatycznie zmniejsza jej endogenne wytwarzanie [Hoberman, 1948; Walker, 1960], a po przejściu na dietę ubogą w kreatynę następuje wzrost tempa jej endogennej syntezy do fizjologicznego poziomu [Persky, 2001].
Ryc. 2. Endogenna synteza kreatyny [Mesa i wsp. 2002]. Objaśnienia: AGAT = amidynotransferaza L-arginino:glicynowa, GAMT = metylotransferaza N- guanidynooctanowa.
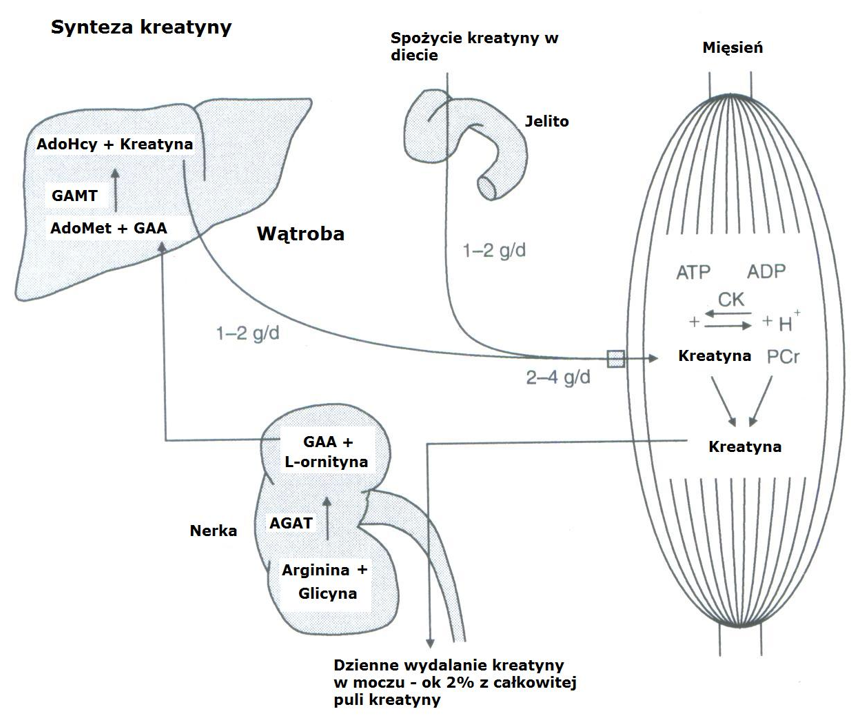
W spoczynku, w komórkach mięśniowych kreatyna jest ufosforylowana przez kinazę kreatynową do fosfokreatyny (PCr) w ciągu 25 minut od wchłonięcia kreatyny przez mięsień. W tym celu ATP powstałe w procesie glikolizy i oksydacyjnej fosforylacji reaguje z kreatyną w wyniku, czego powstaje ADP i PCr. Ładunek ujemny reszty kwasu ortofosforowego będący składową PCr, utrudnia jej dyfuzję przez błonę komórkową włókna mięśniowego do przestrzeni międzykomórkowej [Greenhaff, 1997]. Podczas wysiłku fizycznego, kiedy wzrasta zapotrzebowanie na ATP, reszta kwasu ortofosforowego z PCr przenoszona jest na ADP, w wyniku, czego następuje „błyskawiczne” odtworzenie zasobów ATP. Natomiast powstała kreatyna w tej reakcji zostaje ponownie wykorzystana do odtwarzania PCr lub następuje jej konwersja do kreatyniny. Na całkowitą zawartość kreatyniny w organizmie wpływa zarówno ilość PCr, jak i zmagazynowanej kreatyny. Zatem podstawową rolą PCr jest utrzymanie homeostazy nukleotydów w tkankach w postaci odtwarzania zasobów ATP. Ma to miejsce głównie w wysiłkach krótkich o wysokiej intensywności, kiedy brakuje tlenu w ustroju. Natomiast w warunkach tlenowych, ATP jest odbudowywane przede wszystkim podczas utleniania kwasów tłuszczowych, węglowodanów i aminokwasów w procesie pełnej glikolizy.
Ryc. 3. Metabolizm kreatyny w organizmie [Mesa i wsp. 2002]. Objaśnienia: AdoHcy = S-adenozylo–L-homocysteina, AdoMet = S-adenozylo-L-metionina, AGAT = amidynotransferaza, GAMT = metylotransferaza N- guanidynooctanowa, GAA = guanidynooctan, CK = kinaza kreatynowa, PCr = fosfokreatyna, ATP = adenozynotrifosforan, ADP = adenozynodwufosforan.
Kreatyna w organizmie – gdzie występuje?
Kreatyna (kwas β-metyloguanidynooctowy) jest rozprowadzana po całym organizmie, jednak prawie 90-95% całości zasobów kreatyny występuje w mięśniach szkieletowych [Walker, 1979] (ryc.7). Ponadto wysokie stężenie kreatyny odnotowano w sercu, spermatocytach oraz komórkach fotoreceptorowych. Natomiast średnie jej stężenie występuje w mózgu, brunatnej tkance tłuszczowej, jelitach, pęcherzyku nasiennym, komórkach endothelium i makrofagach, a niski poziom jest w płucach, śledzionie, nerkach, wątrobie, adipocytach oraz erytrocytach [Loike, 1986; Berlet, 1976; Christensen, 1994; Kushmerick, 1992; Lee, 1988; Loike, 1992; Wallimann, 1986].
Harris i wsp. (1974) oszacowali, że u człowieka całkowita zawartość kreatyny w mięśniach mieści się w przedziale 110-160 mmol/kg suchej masy (4-20g/kg suchej masy). Z tego 60% to fosfokreatyna, ale proporcja ta jest istotnie osobniczo zróżnicowana, zależnie od typu włókien mięśniowych i wynosi średnio od 90-180mmol/kg suchej masy. Natomiast stosunek PCr do kreatyny wskazujący na energetyczne naładowanie średnio wacha się w przedziale 0,6-0,8 w mięśniu w spoczynku [Connet, 1988]. W związku z udziałem kreatyny i PCr w przemianach energetycznych ich koncentracja jest ściśle skorelowana z typem włókien mięśniowych [Wyss, 1994]. Na podstawie biopsji oraz badań rezonansem magnetycznym potwierdzono, że zawartość PCr jest od 5-30% większa we włóknach typu II, w stosunku do włókien typu I [Vandenborne, 1995]. Tą zależność zaobserwowano u sprinterów, u których dominują włókna typu II w stosunku do typu I [Saltin, 1974; Neumann, 1990]. Ponadto zaobserwowano, że w spoczynku we włóknach typu II wzrasta ilość PCr, równolegle ze wzrostem ciężkiego łańcucha miozyny, co powoduje, że całkowita pula kreatyny w organizmie zależy od typu włókien mięśniowych [Karatzaferi, 2001]. Ponadto na podstawie biopsji ustalono, że stężenie PCr w mięśniach zależy od wieku i spada prawie o 5% u osób w wieku 52-79 lat (porównywalnie u kobiet i mężczyzn) w odniesieniu do osób o 40 lat młodszych [McCully, 1991; Schunk, 1999]. Sugeruje to, że spadek poziomu PCr w organizmie jest funkcją zależną od wieku, gdyż u osób starszych obserwuje się mniejszą liczbę włókien typu II. Jednakże badania te wykonano na osobach zdrowych i nietrenujących, z czego wynika, że nie da się dokładnie określić, czy spadek zawartości PCr jest efektem wieku, czy brakiem aktywności ruchowej.
Natomiast nie wykazano istotnych różnic poziomu PCr w zależności od płci, chociaż niektóre badania wykazały większą koncentrację kreatyny w stosunku do masy ciała u mężczyzn [Fosberg, 1991], a inne nie wykazały znaczących różnic [Balsom, 1995, Pastoris, 2000]. Wykazano natomiast większą zawartość całkowitej puli kreatyny w mięśniach u kobiet ciężarnych [Forsum, 2000]. Obecnie ocenia się, że jeśli zostanie uwzględniona masa mięśniowa, to nie ma poważnych różnic w zawartości PCr w mięśniach kobiet i mężczyzn. Również badania z wykorzystaniem spektroskopowego rezonansu magnetycznego nie wykazały istotnych różnic w zawartości PCr w mięśniach osób trenujących i nietrenujących [Gariod, 1994], a inne wykazały wyższą zawartość PCr w mięśniu czterogłowym u sprinterów w porównaniu do biegaczy długodystansowych [Bernus, 1993; McCully, 1993; Maurer, 1999]. Jednakże dobór zawodników do dystansu startowego uzależniony był od predyspozycji, do których m.in. zalicza się profil włókien mięśniowych, co sprawia, że do dystansów sprinterskich wybiera się zawodników o przewadze włókien typu II, a do biegów długich o przewadze włókien typu I. Sugeruje to, że na wynik zawartości PCr w mięśniu czworogłowym u biegaczy miał wpływ dobór do dystansu, a nie efekt treningowy [Clark, 1996; Tesch, 1989].