Suplementowanie zawodników kreatyną powiększa zasoby fosfokreatyny w mięśniach, co istotnie wpływa na zwiększenie mocy maksymalnej, dzięki usprawnianiu procesów energetycznych indukujących energię do skurczu mięśniowego [Robinson i wsp. 1999, Nelson i wsp. 2001, van Loon i wsp 2004, Engelhardt i wsp. 1998]. Obecnie uważa się, że kreatyna i jej forma przejściowa fosfokreatyna (PCr) spełniają w mięśniu pięć głównych funkcji wpływających na zdolności wysiłkowe:
1. Dostarczanie „błyskawicznej” energii do skurczu
Energia do skurczu mięśniowego jest pozyskiwana z ATP jako pierwotnego, „błyskawicznego” źródła energii, które się szybko wyczerpuje i musi być natychmiast odbudowane. Najszybciej resynteza ATP zachodzi z udziałem PCr, następnie glikolizy beztlenowej i tlenowej. Odbudowanie zasobów ATP z fosfokreatyny jest „błyskawicznym” źródłem energii do skurczu, odgrywa, więc istotną rolę w wysiłkach sprinterskich oraz w uzyskiwaniu wysokiego potencjału siłowego i mocy maksymalnej. Fosfokreatyna reaguje z ADP, przekazując mu resztę kwasu ortofosforowego, przy udziale enzymu CK, do odbudowy ATP, który zostaje wykorzystany, jako paliwo do dalszej pracy mięśniowej. Następnie w procesie restytucji reakcja ta ulega odwróceniu i następuje odbudowa zasobów komórkowych PCr przy wysokim poziomie Cr i ATP [Yquel i wsp. 2002, Vandenberghe i wsp. 1999, Tarnopolsky i wsp. 2003, Wallimann i wsp. 1992, Bessman i Geiger 1981, Söderlund i Hultman 1991, Saks i wsp. 1996, Arciero i wsp. 2001].
Należy zaznaczyć, że powyższy proces zachodzi zarówno we włóknach typu I, jak i II, ale w większym stopniu dotyczy to włókien szybkich – typ II. Ponadto stwierdzono, że wysiłek o maksymalnej intensywności, trwający 10-30sek powoduje spadek zawartości PCr w mięśniach, na skutek jej hydrolizy i spadek ten jest szybszy we włóknach typu II w porównaniu do włókien typu I [Greenhaff, 1994; Karatzaferi, 2001], co sugeruje większe tempo hydrolizy PCr we włóknach typu II. Wzrost tempa syntezy ATP powstałego z hydrolizy PCr do poziomu 10-15mmol/kg/s oraz limitowana zawartość PCr w mięśniu (około 70-90mmol/kg/s.m) powoduje, że zasoby PCr przeznaczone dla resyntezy ATP znacząco obniżają się w wysiłkach trwających ponad kilka sekund [Terjung, 2000]. Tempo tego spadku jest tym większe im dłuższy jest wysiłek. Dzięki temu podczas 6s sprintu, o intensywności 250% VO2max hydroliza PCr dostarcza 50% ATP, wymaganych do skurczu mięśniowego, drugie 50% dostarcza glikoliza, przy bardzo niewielkim udziale fosforylacji oksydacyjnej [Gaitanos, 1993]. Jednakże już przy 30s sprincie o intensywności na poziomie 200% VO2max hydroliza PCr dostarcza już tylko 25% ATP potrzebnego do skurczu [Spriet, 1995].
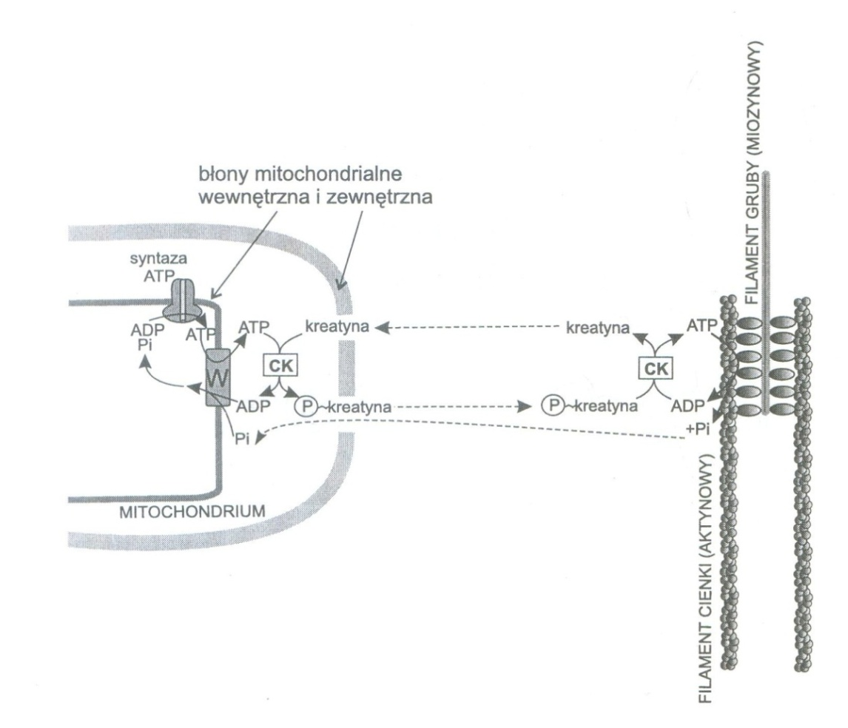
Ryc. 1. Transport wysokoenergetycznych grup fosforanowych przez kreatynę wg S.P. Bessmana. Objaśnienia: W = translokaza, Pi = jon fosforanowy, CK = kinaza kreatynowa, ATP = adenozynotrifosforan, ADP = adenozynodifosforan, P-kreatyna = fosfokreatyna
Należy podkreślić, że zarówno kreatyna, jak i PCr uczestniczy w dowozie grup fosforanowych z mitochondriów w okolice mostków aktyno miozynowych włókna mięśniowego dla odbudowy ATP (ryc. 1).
Badania potwierdzają, że doustna suplementacja kreatyną istotnie wpływała na zawartość kreatyny w mięśniach, zarówno w formie wolnej, jak i związanej z fosforanem (PCr), co ma również znaczący wpływ na osiągany wynik w wysiłkach krótkich trwających 0-30 s o dużej intensywności, generując wzrost mocy maksymalnej [Trzaskoma i Trzaskoma 1999, Kraemer i wsp. 1996, Syrotuik i wsp. 2000, Stevenson i Dudley 2001, Dawson i wsp. 1997, Bogdanis i wsp. 1995, Levesque i wsp. 2007].
2. Odbudowa ATP po wysiłku fizycznym
Po treningu, w mięśniach muszą być odbudowane zasoby ATP z udziałem miedzy innymi PCr, która ulega hydrolizie do Cr i Pi. Z kolei odtwarzana jest pula PCr z udziałem ATP i Cr. W przeszłości zaproponowano prosty model opisujący tą zależność, który zakładał wykładnicze, stałe tempo obu tych reakcji [Di Pramispero, 1969; Meyer, 1988]. Jednakże najnowsze badania wykazały, że początkowa odbudowa PCr zachodzi szybciej, a następnie zwalnia [Harris, 1976; Bogdanis, 1995; McCann, 1995]. Ponadto zaobserwowano, że koncentracja PCr we włóknach typu II jest wyższa podczas wypoczynku po wysiłku, niż przed nim [Kushmerick, 1992; Nevil, 1995]. Podczas pracy resynteza PCr ulega zahamowaniu, a następnie podczas wypoczynku jest kontynuowana dzięki zwiększonemu przepływowi krwi. W spoczynku, dostarczanie do mięśnia tlenu oraz usuwanie metabolitów takich jak mleczan i jony H+ determinuje szybkość resyntezy PCr [Sahlin, 1979] w sposób taki, że podwyższony przepływ krwi zwiększa resyntezę PCr podczas wypoczynku. Po wysiłku zachodząca resynteza PCr umożliwia odbudowę zasobów ATP w komórce mięśniowej z wykorzystaniem kinazy kreatynowej. Co najważniejsze resynteza PCr po wysiłku fizycznym jest reakcją zachodzącą w warunkach tlenowych [Sahlin, 1975] i jest proporcjonalna od poboru tlenu przez mitochondrium [Meyer, 1988; Mahler, 1985; Takahashi, 1995; Thompson, 1995]. Fakt ten ma istotne znaczenie w treningu sportowym dyscyplin bazujących na szybkich źródłach energii (sprinty, rzuty, itd.), gdyż uzasadnia potrzebę rozbudowy potencjału tlenowego zawodników (VO2max), w celu ładowania PCr podczas odpoczynku. Stworzy to dobre warunki energetyczne dla kolejnego wysiłku o wysokiej intensywności. Należy również dodać, że w związku z tlenowym charakterem procesu resyntezy PCr włókna typu I odznaczają się szybszą resyntezą PCr podczas 60s wypoczynku, niż włókna typu II [Tesch, 1989]. Ponadto zaobserwowano, że tempo resyntezy PCr jest niższe u osób starszych, w porównaniu do młodszych, a spadek ten jest na poziomie 8% dla każdej dekady życia, po 30r.ż [McCully, 1993; McCully, 1991].
W trakcie spoczynku komórki mięśniowe nie potrzebują dużych ilości ATP, co sprawia, że kinaza kreatynowa utrzymująca homeostazę ATP/ADP, (ryc. 1) odwracalnie przenosi wysokoenergetyczną grupę fosforanową z ATP do grupy guanidynowej kreatyny, w wyniku, czego powstaje ADP i PCr oraz H+. Powstała PCr w tym systemie spełnia funkcję buforu energetycznego, stanowiącego „paliwo” dla innych reakcji, oraz buforu fizjologicznego [Wyss, 2000]. Ponadto wysoka aktywność CK w komórce (w cytozolu) mięśniowej sprawia, że stosunek ATP/ADP jest prawie stały.
3. Transport ATP – czółenko kreatynowe
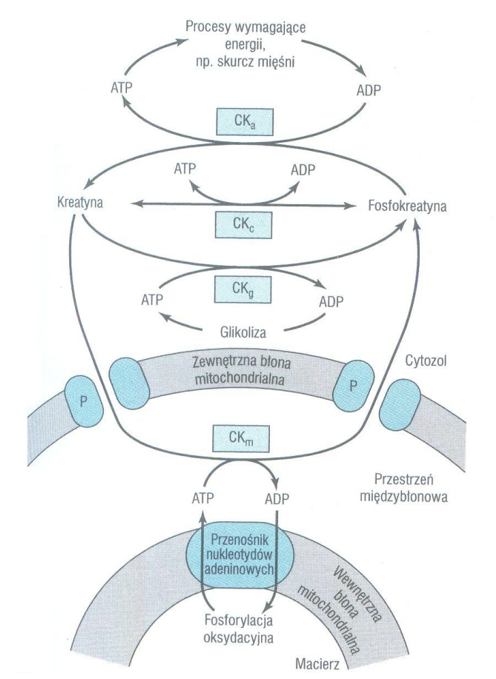
W mitochondrium, w przestrzeni między błonowej istnieją dwie izoformy enzymu kinazy kreatynowej: pierwsza to ubikwitynowe mitochondrialne CK (CKum) oraz mięśniowe mitochondrialne CK (CKm). Ponadto w komórce, w cytozolu występuje kinaza kreatynowa ułatwiająca przebieg procesów wymagających znacznych ilości ATP, takich jak skurcz mięśniowy (CKa), kinaza kreatynowa utrzymująca homeostazę ATP/ADP (CKc) oraz kinaza kreatynowa (CKg) sprzęgająca glikolizę z syntezą PCr. Izoenzymy kinazy kreatynowej zawartej w mitochondriom są wspólnie nazywane mitochondrialną kinazą kreatynową (CKm), natomiast kinazy kreatynowe występujące w cytozolu CKa, CKc oraz CKg są nazywane wspólnie cytozolową CK, gdyż są one tą samą izoformą enzymu CK, ale spełniającą w cytozolu różne funkcje. Mitochondrialne CK umożliwia wbudowanie powstałego z fosforylacji oksydacyjnej ATP w kreatynę, a powstająca fosfokreatyna transportowana jest przez pory białkowe w zewnętrznej błonie mitochondrialnej do cytozolu, gdzie zostaje wykorzystana do tworzenia pozamitochondralnego ATP, głównie w okolicy mostków aktyno miozynowych włókna mięśniowego [Belister, 1939; Bessman, 1981; Bessman, 1990]. W reakcjach pozamitochondrialnego „odzyskania” ATP do skurczu mięśniowego z PCr bierze udział cytozolowa CK (CKa) (ryc. 2).
Ryc. 2. „Czółenko” keratynowe [Biochemia Harpera s.137] Objaśnienia: CKa = kinaza kreatynowa ułatwiająca przebieg procesów wymagających znacznych ilości ATP, takich jak np. skurcz mięśniowy, CKc = kinaza kreatynowa utrzymująca równowagę między kreatyną i fosfokreatyną a ATP/ADP, CKg = kinaza kreatynowa sprzęgająca glikolizę z syntezą fosfokreatyny, CKm = mitochondrialna kinaza kreatynowa uczestnicząca w produkcji fosfokreatyny z ATP tworzonego w procesie fosforylacji oksydacyjnej, P = por białkowy w zewnętrznej błonie mitochondrialnej.
4. Regulacja glikolizy i metabolizm glikogenu
W komórce fosfokreatyna jest częściowym inhibitorem enzymu fosfofruktokinazy, która jest kluczowym enzymem glikolizy. Podczas intensywnego wysiłku fizycznego zmniejsza się stopień inhibicji fosfofruktokinazy przez PCr, z racji na zmniejszającą się zawartość PCr w komórce, powodując wzrost procentowego udziału glikolizy w odtwarzaniu zasobów ATP wraz z czasem trwania intensywnego ćwiczenia. Ponadto, jeśli tkanki zostaną pozbawione kreatyny, adaptują się do tego poprzez wzrost poziomu enzymów oksydacyjnych takich, jak: dehydrogenaza bursztynianowa, syntaza cytrynianowa [O’Gorman, 1996; Ren, 1993].
5. Stabilizacja błony komórkowej
Fosfokreatyna stabilizuje błonę komórkową, co związane jest z faktem, że jest cząsteczką posiadającą równą liczbę grup zjonizowanych o przeciwnych ładunkach, co sprawia, że sama nie jest ani naładowana dodatnio, ani ujemnie (amfijon). Ładunek ujemny posiada grupa fosforanowa i kwasowa, a ładunek dodatni grupa guanidynowa. Fosfokreatyna łączy się z częścią hydrofobową fosfolipidów (head) i dzięki temu zmniejsza przepuszczalność błon komórkowych, ograniczając w ten sposób transport składników cytozolu komórki do przestrzeni międzykomórkowej [Persky, 2008].